مدخل الى الكيمياء العضوية. الاجابة عن أهم الأسئلة
مدخل الى الكيمياء العضوية. الاجابة عن أهم الأسئلة
يحتوي مدخل الى الكيمياء العضوية.
الاجابة عن أهم الأسئلة على العناصر التالية: الكربون عنصر أساسي في الأنواع
العضوية، الجانب التاريخي للكيمياء العضوية، تعريف الكيمياء العضوية، التحليل العنصري
الكيفي لنوع كيميائي عضوي، إثبات أن السكر
مادة عضوية، إثبات أن النشاء مادة عضوية، الكشف عن
عنصر النيتروجين N في مركب عضوي، الفحوم الهدروجينية، السلاسل الفحمية المختلفة، الفحوم الهيدروجينية ذات
السلاسل المفتوحة، الفحوم الهيدروجينية ذات السلاسل الحلقية، الهندسة الفضائية للفحوم
الهيدروجينية (جزئ الايثان، جزئ الإيثلين، جزئ الاستلين)، التماكب التسلسلي، التماكب الموضعي، تسمية الألكانات، الألسانات،
الألسينات، الكتابة الطوبولوجية للفحوم الهيدروجينية، العائلات الأخرى (الأمينات، الكحولات، الألدهيدات،
الكيتونات)، الكشف عن المجموعة المميزة في بعض العائلات، التعرف على الألدهيــد مخبريا، الكشف عن الوظيفة الألدهيدية
بواسطة محلول فهلنج، الكشف عن وظيفة الكربونيل، تأثير السلسة الفحمية على الخواص الفيزيائية، تأثير السلسلة الفحمية على
انحلال الكحولات في الماء، تأثير السلسلة الفحمية على درجة غليان الأنواع
الكيميائية العضوية، المرور من مجموعة مميزة الى أخرى، ٳماهة الألسان، الأكسدة المقتصدة للكحول، نزع الماء من الكحول.
1 ـ الكربون عنصر أساسي في الأنواع العضوية:
1ـ 1 ـ الجانب التاريخي للكيمياء العضوية:
ـ ما هو العمل الذي قام به الكيميائي الفرنسي نيكولا ليمري سنة 1690 ؟
في سنة 1690، ميز نيكولا ليميري بين الكيمياء المعدنية، والكيمياء العضوية، باعتبار أن هذه الأخيرة تدرس المركبات العضوية، التي تنتجها العضويات في الكائنات الحية النباتية، أو الحيوانية.
ـ ما هو العمل الذي قام به العالم الألماني وولر سنة 1828 ؟
في سنة 1828، استطاع العالم الألماني وولر أن يصنع مادة البولةCO(NH2)2 ، وحمض الحماضC2O2H2 ، وهما مركبان عضويان تنتجهما عضويات الكائنات
الحية، من مركبات معدنية صرفة، وأبطل
الاعتقاد، الذي كان ينص على أنه لا يمكن الحصول على مادة عضوية من غير الكائن الحي.
ومنذ ذلك الحين توالت الاكتشافات، وأصبحت الكيمياء
العضوية علما بحد ذاته.
1 ـ 2 ـ تعريف الكيمياء العضوية:
ـ الكيمياء العضوية، هي الكيمياء التي
تهتم بدراسة المركبات الفحمية، أي المركبات التي يدخل في تركيبها عنصر الكربون.
ـ تهتم الكيمياء العضوية بدراسة، وتحليل كل المركبات
التي تحتوي في تركيبها على العنصرين الكيميائيين الكربون، والهيدروجين كعنصرين
أساسيين، وبعض العناصر الأخرى كعناصر ثانوية مثل الأكسجين، والنيتروجين ...
الخ.
1 ـ 3 ـ التحليل العنصري الكيفي لنوع كيميائي عضوي:
أ ـ اثبات
أن السكر مادة عضوية:
ضع قليلا من السكر في أنبوبة
اختبار، ثم ضف له بعض القطرات من حمض الكبريت المركز، وسخن قليلا مع الرج.
ـ ماذا
تلاحظ ؟
نلاحظ انطلاق بخار، يتكاثف
على شكل قطرات من الماء على جدران الأنبوب، كما نلاحظ بقايا سوداء أسفله هي
الكربون.
ـ اقترح طريقة للكشف عن الكربون؟
نكشف عنه بحرقه بوجود
الأكسجين، لينطلق غاز ثاني أكسيد الكربون.
ـ هل السكر مركب عضوي ؟ لماذا ؟
نعم السكر مركب عضوي، لأنه يحتوي على عنصر الكربون.
ب ـ إثبات أن النشاء مادة عضوية:
ضع في أنبوب اختبار كمية من
النشاء، وقليل من أكسيد النحاس، ضف له قليلا من حمض الكبريت المركز، سد فوهة الأنبوب، وحقق
التركيب المبين في الشكل المقابل، ثم سخن الأنبوب بلطف.
ـ ماذا تلاحظ في الأنبوب وفي الكأس؟ وماذا تستنتج ؟
في الأنبوب نلاحظ تكاثف بخار
على شكل قطرات من الماء، وفي الكأس نلاحظ تعكر رائق الكلس دليل على وجود غاز الفحم.
ـ ماذا
تستنتج ؟
نستنتج أن النشاء يحتوي على عنصر الكربون، فهو
مركب عضوي.
جـ ـ الكشف
عن عنصر النيتروجين N في مركب عضوي:
ضع في أنبوب اختبار كمية من البولة مع كمية من الكلس الصودي.
سخن المزيج بشدة.
ـ ماذا
تلاحظ ؟
نشاهد انبعاث أبخرة وغازات.
ـ قرب من
فوهة الأنبوب ورق PH مبلل بالماء، ماذا تلاحظ ؟ وماذا تستنتج ؟
نلاحظ تلون ورق الـ PH بلون أزرق. دليل على تشكل مركب أساسي.
ـ قرب
الآن من فوهة الأنبوب قضيبا زجاجيا مبللا بحمض كلور الماء ـ ماذا يحدث ؟ ماذا
نستنتج ؟ ولماذا ؟
نلاحظ تشكل دخان أبيض من
كلور النشادر NH4Cl، وهذا ناتج
عن غاز النشادر NH3 المنبعث من الأنبوب أثناء
التسخين.
ـ ما هو
مصدر عنصر النيتروجين N ؟
مصدر عنصر النيتروجين هو البولة.
ـ يكشف عن عنصري الكربون والهيدروجين
في مركب عضوي: إما بتسخينه اذا كان سهل
التحلل، أو بأكسدته بالأكسجين، أو أي مؤكسد. فيعطي الماء عنصر الهيدروجين، أما الكربون فيبقى فحما أسودا، أو يتأكسد بالأكسجين معطيا ثاني أكسيد الكربون.
ـ يكشف عن عنصر النيتروجين في مركب عضوي، بتحويله إلى غاز النشادر، الذي يعرف برائحته، أو بواسطة حمض الكلور.
2 ـ الفحوم الهدروجينية:
هي الأنواع الكيميائية، التي تتألف جزيئاتها
من عنصري الكربون، والهيدروجين، الصيغة العامة لها من الشكل CxHy، تصنف إلى صنفين
حسب بنية هيكلها الكربوني.
2 ـ 1 ـ السلاسل الفحمية المختلفة:
أ ـ الفحوم الهيدروجينية ذات السلاسل المفتوحة:
تكون فيها ذرات الكربون مرتبطة فيما بينها، مشكلة سلسلة مفتوحة خطية،
أو متفرعة.
CH3
– CH2 – CH2 – CH3 البوتان: C4H10
ب ـ الفحوم الهيدروجينية ذات السلاسل الحلقية:
ترتبط فيها ذرات الكربون مشكلة حلقة:

جـ ـ الهندسة الفضائية للفحوم الهيدروجينية:
ـ ما هي العوامل التي تؤدي الى اختلاف الهندسة الفضائية للفحوم الهيدروجينية ؟
تختلف الهندسة الفضائية
للفحوم الهيدروجينية، باختلاف عدد، ونوع الروابط التكافؤية الموجودة في الجزيء، وعدد
ذرات الكربون فيها.
ـ أعط
أمثلة توضح اختلاف الهندسة الفضائية ؟
جزئ الايثان:
له بنية فراغية (فضائية)
توجد به 7 روابط تكافئية بسيطة من نوع σ.
الصيغة المجملة له: C2H6
الصيغة النصف مفصلة له: CH3ـ CH3
جزئ الإيثلين:
بنيته
مستوية توجد به 5 روابط تكافئية بسيطة من نوع σ، ورابطة تكافئية من نوع π.
الصيغة المجملة له: C2H4.
الصيغة النصف مفصلة له:
الصيغة المفصلة:
CH2 = CH2
جزئ الاستلين:
بنيته
خطية توجد به 3 روابط تكافئية بسيطة من نوع σ، ورابطتين من نوع π (رابطة ثلاثية).
الصيغة
المجملة له: C2H2
الصيغة النصف مفصلة له: CH ≡ CH
الصيغة المنشورة له: H - C ≡ C - H
2 ـ 2 ـ التماكب التسلسلي:
ـ ماذا نعني بالتماكب التسلسلي ؟
هي مماكبات تختلف في شكل
سلاسلها.
ـ وضح التماكب التسلسلي بمثال ؟
CH3 – CH2 – CH2 – CH2
– CH3
CH3 – CH2 – CH(CH3) –
CH3
CH3 – C(CH3)2 – CH2
2 ـ 3 ـ التماكب الموضعي:
ـ ماذا نعني بالتماكب الموضعي؟
للمماكبات نفس السلسلة الرئيسية والجذور، ولكنها تختلف في
مواضع التفرع.
ـ وضح التماكب الموضعي بمثال؟
CH3 – CH(CH3) – CH2 – CH2
– CH3
CH3 – CH3 – CH(CH3) – CH2
– CH3
2 ـ 4 ـ التسمية:
تصنف الفحوم الهيدروجينية إلى صنفين:
ـ فحوم هيدروجينية مشبعة، تحتوي جزيئاتها على روابط
تكافئية بسيطة فقط.
ـ فحوم هيدروجينية غير مشبعة، تحتوي جزيئاتها على الأقل
رابطة ثنائية أو ثلاثية.
أ ـ الألكانات:
فحوم هيدروجينية مشبعة، سلاسلها خطية، الصيغة العامة لها من الشكل: CnH2n+2 أسماؤها
مركبة من جزأين.
ـ سـابقة (Préfix): من أصل إغريقي، وهذا من أجل n أكبر من 4، حيث تدل على عدد ذرات
الكربون التي يحتويها المركب.
ـ لاحقـة (ane) مشتركة في كل أسماء المركبات حيث تميز العائلة.
ـ قدم أمثلة عن أسماء بعض الألكانات ؟
أسماء بعـض الألكانات:
|
الاســم اللاتيــني |
الاســم بالعربية |
الصيغة المجملــة |
n
عدد ذرات الكربون |
|
Méthane |
ميثان |
CH4 |
1 |
|
Ethane |
إيثان |
C2H6 |
2 |
|
Propane |
بروبان |
C3H8 |
3 |
|
Butane |
بوتان |
C4H10 |
4 |
|
Pentane |
بنتان |
C5H12 |
5 |
|
Hexane |
هكسان |
C6H14 |
6 |
ب ـ الجذور الألكيلية:
هي مركبات مشتقة من
الألكانات، بحذف ذرة هيدروجين واحدة منها،
الصيغة العامة لها من الشكل:
CnH2n+1 كما يرمز لها أيضا بالرمز R–
ـ كيف تسمى الجذور الألكيلية ؟
تسمى الجذور الألكيلية بتعوض اللاحقة (ane) في الألكان، باللاحقة (yle)، وتقرأ ألكيل.
ـ قدم أمثلة عن أسماء بعض الجذور الألكيلية ؟
أسماء بعـض الجذور الألكيلية:
|
الاســم اللاتيــني |
الاســم بالعربية |
الصيغة المجملــة |
n
عدد ذرات الكربون |
|
Méthyle |
ميثيل |
- CH3 |
1 |
|
Ethyle |
ٳيثيل |
- C2H5 |
2 |
|
Propyle |
بروبيل |
- C3H7 |
3 |
|
Butyle |
بوتيل |
- C4H9 |
4 |
|
Pentyle |
بنتيل |
- C5H11 |
5 |
|
Hexyle |
هكسيل |
- C6H13 |
6 |
ـ ماهي قواعد تسمية الألكانات ذات السلاسل المتفرعة وفق (IUPAC) ؟
قواعد تسمية الألكانات ذات السلاسل المتفرعة وفق (IUPAC):
1 ـ أكتب الصيغة المنشورة (المفصلة)، أو النصف المفصلة
للمركب المعني.
CH3 – CH2 – CH(CH3) – CH2 – CH2 – CH3
2 ـ أختار السلسلة الرئيسية الأطول، (التي تشمل على أكبر عدد من
ذرات الكربون).

3 ـ أرقم ذرات كربون السلسلة انطلاقا من طرفها الأقرب إلى الجذر،
حيث يأخذ الكربون المتصل به أصغر رقم ممكن.

4 ـ من أجل تسمية الألكان نقوم بما يلي:
ـ نكتب رقم ذرة الكربون المتصلة بالجذر الألكيلي، متبوع بخط (مطه)، ثم اسم الجذر الألكيلي، متصل باسم السلسلة الكربونية، منتهية باللاحقة (آن) أو (ane)
3- méthylhéxane أو 3 ـ ميثيل هكسان
ـ أوجد مماكبات البنتان C5H12 مع التسمية.
بنتان (Pentane)
CH3 – CH2 – CH2 – CH2 – CH3
2 ـ ميثيل بوتان
CH3CH2CH(CH3)CH3
2 ، 2 ـ ثنائي ميثيل بروبان
CH3 - C(CH3)2 - CH2
1ـ في حالة وجود جذرين متماثلين، أو أكثر في
السلسلة، يكتب الاسم بكتابة أرقام هذه الجذور، بينهما فاصلة، ثم اسم الجذر مزود باللاحقة
di (ثنائي)، أو tri
(ثلاثي) ... التي تدل على مرات تكرارها.
2 ، 3 ـ ثنائي ميثيل بوتان.
CH2 - CH(CH3) - CH(CH3) - CH
2 ـ في حالة
وجود جذرين مختلفين، أو أكثر في السلسلة، نطبق نفس قواعد التسمية السابقة، فقط
أثناء كتابة الجذور تكتب وفق الأسبقية الأبجدية اللاتينية لأسمائها، مع وضع فاصلة بعد اسم كل جذر.
3 ـ اثيل ، 4 ـ ميثيل هكسان
CH3 - CH2 - CH(C2H5) - CH(CH3) - CH2 - CH3
جـ ـ الألسانات:
فحوم هيدروجينية غير
مشبعة، تحتوي سلاسلها الكربونية على رابطة مزدوجة
(ثنائية) وحيدة بين ذرتي كربون، وهي المجموعة المميزة لهذه العائلة، الصيغة العامة لها من الشكل CnH2n.
ـ كيف تسمى الألسانات ؟
تسميتها تتم بأن:
1 ـ نختار أطول سلسلة كربونية تحتوي على الرابطة
المزدوجة.

2 ـ نبدأ ترقيم السلسلة من الطرف الأقرب إلى الرابطة المزدوجة.

3 ـ نسمي الجذور إن وجدت، ونعين أرقام ذرات الكربون التي تحملها.
4 ـ نكتب اسم المركب كالتالي:
ـ رقم ذرة الكربون المتصلة بالجذر الألكيلي متبوع بخط (مطه)، ثم اسم الجذر الألكيلي متصل باسم السلسلة الكربونية، ثم خط (مطه)، ثم الرقم الأصغر لذرة الكربون المتصلة بالرابطة الثنائية، ثم خط (مطه)، ثم اللاحقة (ٳن) أو (éne)
3 ـ مثيل هكس ـ 1 ـ ٳن
CH = C - CH(CH3) - CH2 - CH2 - CH3
د ـ الألسينات:
فحوم هيدروجينية غير مشبعة، تحتوي سلاسلها الكربونية على رابطة ثلاثية، وحيدة بين ذرتي كربون، وهي المجموعة المميزة لهذه العائلة.
الصيغة العامة
لها من الشكل CnH2n-2.
ـ وضح كيف تسمية الألسينات مع اعطاء مثال؟
نختار أطول سلسلة كربونية تحتوي على الرابطة الثلاثية، ويكتب اسم المركب
باعتماد القواعد السابقة مع الإشارة للرابطة الثلاثية باللاحقة (yne).
3 ـ ميثيل هكس ـ 1 ـ ين
CH ≡ C - CH(CH3) - CH2 - CH2 - CH3
2 ـ 5 ـ الكتابة
الطوبولوجية للفحوم الهيدروجينية:
ـ عرف الكتابة الطوبولوجية ؟
تعرف الكتابة الطوبولوجية، على أنها التمثيل الرمزي
للهيكل الكربوني للجزيء، (تمثيل سلسلة كربوناته)، ويتم ذلك بتمثيل الروابط
الكربونية، دون كتابة رمز عنصر الكربون.
ٳصطلاحا: عبارة عن خط متواصل منكسر، مكون من قطع مستقيمة
متساوية الطول حيث نهاية قطعة، أو التقاء قطعتين، أو ثلاثة توافق موقع ذرة كربون.
ـ قدم أمثلة عن مختلف الكتابات الطوبولوجية للفحوم الهيدروجينية ؟
المركـب: CH3 - CH2
- CH2 - CH2 - CH3
الهيكل الكربوني: C - C - C - C - C
الكتابة الطوبولوجية:

المركــب: CH3 - CH2
- CH = CH2
الهيكل الكربوني: C - C - C = C
الكتابة الطوبولوجية:

المركب: CH3 – C ≡ C – CH2 – CH3
الهيكل الكربوني: C – C ≡ C – C – C
الكتابة الطوبولوجية:

3 ـ العائلات
الأخرى:
3 ـ 1 ـ الأمينات:
مركبات عضوية آزوتية،
ناتجة من النشادرNH3، باستبدال
ذرة هيدروجين، أو أكثر بجذر ألكيلي، أو أكثر.
الصيغة العامة لها من الشكل CnH2n+3N. تعتبر ذرة الآزوت N ممثل الوظيفة الأمينية، وهي
المجموعة المميزة للأمينات.
ـ ماهي أصناف الأمينات ؟
توجد الأمينات
على ثلاثة أصناف:
أ ـ أمينات أولية:
وفيها تكون الذرة N
متصلة بجذر ألكيلي واحد: R – NH2.
ب ـ أمينات ثانوية:
وفيها تكون الذرة N متصلة بجذرين
الكيليين:
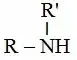
جـ ـ أمينات ثالثية:
وفيها تكون الذرة N
متصلة بثلاثة جذور الكيلية:

ـ وضح طريقة تسمية الأمينات مع إعطاء مثال عن كل حالة ؟
ـ تسمى الأمينات الأولية بإضافة أمين (Amine) إلى ٳسم الالكان الموافق.
CH3 – CH2 – CH2 – NH2
propanamine (بروبان أمين)
ـ لتسمية
الأمينات الثانوية، نعتبر الجذر الألكيلي الأطول كأساس لتسمية الأمين، والجذور
الأخرى كجذور مستبدلة، وتكون التسمية كالتالي:
نكتب N ثم خط
(مطه)، ثم ٳسم الجذر الألكيلي المستبدل، ثم ٳسم الجذر الألكيلي الأطول على أساس أنه
الكان، ثم اللاحقة (أمين).

ـ تسمية الأمينات الثالثية:
مثال:
N ـ ٳيثيل، N ـ ميثيل بروبان أمين
CH3 – CH2 – N(CH3) – CH2 – CH2 – CH3
3 ـ 2 ـ الكحــولات:
مركبات عضوية أكسجينية، الصيغة العامة لها من الشكل CnH2n+1-OH أو
R–OH ، حيث R
يرمز للجذر الألكيلي، و(-OH)
تسمى مجموعة الهيدروكسيل، وهي المميزة
للكحولات.
ـ كيف تسمى الكحولات ؟
يسمى
الكحول باسم الألكان المشتق منه، مع
إضافة اللاحقة (ول) (ol).
ـ أذكر أصناف الكحولات مع مثال عن التسمية ؟
تنقسم الكحولات إلى ثلاثة
أصناف:
أ ـ الكحولات الأولية:
وفيها تكون ذرة الكربون الحاملة لـ (-OH)متصلة بجذر ألكيلي واحد.
R – CH2 – OH
CH3 – CH2 – OH éthanol
(ٳيثانول)
ب ـ الكحولات الثانوية:
وفيها تكون
ذرة الكربون الحاملة لـ (-OH) متصلة بجذرين الكيليين.

بوتان ـ 2 ـ ول
CH3 – CH(OH) – CH2 – CH3
وفيها تكون ذرة الكربون الحاملة لـ (OH) متصلة بثلاثة جذور ألكيلية.

2 ـ ميثيل بوتان ـ 2 ـ ول
CH3 – CH2 – C(CH3)2 – OH
3 ـ 3 ـ الألدهيدات:
مركبات عضوية أكسجينية تحتوي سلاسلها على المجموعة الوظيفية الألدهيدية.

وهي المجموعة المميزة لهذه العائلة، الصيغة العامة لها من الشكل CnH2nO
ـ وضح طريقة تسمية الألدهيدات مع ٳعطاء أمثلة مناسبة ؟
تتم تسميتها بإضافة
اللاحقة (آل) (al) ٳلى ٳسم الألكان الموافق.

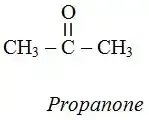
3 ـ 4 ـ الكيتونات:
مركبات عضوية أكسجينية تحتوي سلاسلها على المجموعة الوظيفية الكيتونية.
وهي المجموعة المميزة
لهذه العائلة، الصيغة العامة لها من الشكل CnH2nO
ـ وضح طريقة تسمية الكيتونات مع ٳعطاء أمثلة مناسبة ؟
تتم تسميتها بإضافة اللاحقة (ون)
(one)
ٳلى ٳسم الألكان الموافق.
حيث أن أول مركب في هذه العائلة هو Propanone
4 ـ الكشف عن المجموعة المميزة في بعض العائلات:
أ ـ التعرف
على الألدهيــد مخبريا:
نسخن سلك من النحاس حتى
التوهج ثم نغمسه في أبخرة الايثانول.
نلاحظ أنه يزداد توهجا (أكسدة
مقتصدة للإيثانول)، كما يرافق ذلك انبعاث رائحة تشبه رائحة التفاح، دليل على تشكل
الألدهيد (ٳيثانال).
عند أكسدة الكحول أكسدة مقتصدة
نحصل على ألدهيد ثم حمض
كربوكسيلي.
ب ـ الكشف
عن الوظيفة الألدهيدية بواسطة محلول فهلنج:
نضع في أنبوبة اختبار كمية
من الميثانال، ونضيف له بضع قطرات من محلول فهلنج، ونضعه في حمام مائي دافئ.
ـ بعد مدة
زمنية ماذا نلاحظ ؟
بعد مدة نلاحظ تشكل أكسيد النحاس ذو اللون الأحمر الاجوري، دليل على حدوث تفاعل كيميائي بين الميثانال ومحلول فهلنج.
أي مادة عضوية تعطي لونا أحمر أجوري
مع محلول فهلنج فهي ألدهيد.
ـ للكشف عن الألدهيد
نستخدم كاشف محلول فهلنج.
جـ ـ الكشف عن وظيفة الكربونيل:
1 ـ نضع في أنبوبة
اختبار1ml من البروبانون (اسيتون) العديم اللون، ونضيف له
2ml من كاشف DNPH الاصفر اللون. بعد الرج.
ـ ماذا
نلاحظ ؟
نلاحظ تشكل راسب أصفر
برتقالي.
2 ـ نعيد التجربة السابقة
باستبدال البروبانون بالميثانال العديم اللون، بعد الرج.
ـ ماذا
نلاحظ ؟
نلاحظ أيضا تشكل راسب أصفر
برتقالي.
أي مادة عضوية تشكل
راسبا أصفر برتقالي مع كاشف DNPH، فهي تحتوي على وظيفة الكربونيل، وتنتمي إلى عائلة الألدهيدات أو الكيتونات.
هناك كواشف أخرى تستخدم للكشف عن الألدهيد منها: كاشف
شيف، الذي يعطي اللون الوردي أثناء إضافته للألدهيد، وكاشف Tollens الذي يعطي
راسبا فضيا عند اضافته للألدهيد.
5 ـ تأثير
السلسة الفحمية على الخواص
الفيزيائية:
أ ـ تأثير السلسلة الفحمية على انحلال الكحولات في الماء:
لدينا
الكحولات التالية:
CH3 - OH méthanol
(ميثانول).
CH3 - CH2 - OH éthanol
(ايثانول).
CH3 - CH2 - CH2
- CH2 - OH butane - 1 - ol
(بوتان ـ 1 ـ ول)
CH3 - CH2 - CH2 -
CH2 - CH2 - OH pentane - 1 - ol
(بنتان ـ 1 ـ ول)
نضع في أربعة أنابيب ٳختبار حجما معينا من الماء المقطر(10 ml)، ونضيف لكل
واحد منها على الترتيب 2ml من الكحولات
السابقة.
ـ ماذا نلاحظ بعد مدة معينة ؟
بعد مدة معينة، نلاحظ أن الانبوبين اللذان يوجد بهما méthanol
و ethanol، قد امتزجا كلية مع الماء، نقول عنهما
انهما انحلا في الماء. بينما تظهر في الانبوبين الاخرين طبقتين منفصلتين (عدم
الامتزاج)، ويبدو ذلك جليا بعد الرج أي أنButan
-1-ol ، و pentane-1-ol لم
ينحلا في الماء.
الكحولات الأولى (n≤3)تنحل في الماء بسهولة، وتزداد صعوبة انحلالها في الماء كلما ازداد عدد ذرات الكربون في السلسلة. أي أن انحلالها في الماء يتوقف على عدد ذرات الكربون في سلاسلها.
ب ـ تأثير السلسلة الفحمية على درجة غليان الانواع الكيميائية العضوية:
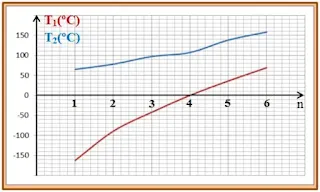
يوضح الجدول التالي، درجة غليان بعض الأنواع الكيميائية
العضوية عند ضغط معين.
|
درجة الغليان T2(ºC) |
الكحول الأولي OHـR |
درجة الغليــان T1(ºC) |
الألكان Cn H2n + 2 |
n عدد ذرات الكربون |
|
65 |
Méthanol |
-162 |
Méthane |
1 |
|
78 |
Ethanol |
-89 |
Ethane |
2 |
|
97 |
Propane-1-ol |
-42 |
Propane |
3 |
|
107 |
Butane-1-ol |
0 |
Butane |
4 |
|
138 |
Pentane-1-ol |
36 |
Pentane |
5 |
|
158 |
Hexane-1-ol |
69 |
Hexane |
6 |
ـ أرسم المنحنيين البيانيين T1 = f(n) ، T2 = h(n) ؟
.webp)
1/ نستنتج أن درجة غليان
الأنواع الكيميائية العضوية عند ضغط معين، تزداد بازدياد عدد ذرات الكربون في
السلسلة، أي تتناسب تناسب طردي مع n عدد ذرات الكربون.
2/ نستنتج أن درجة غليان الكحول أكبر من درجة غليان الألكان المشتقة منه.
6 ـ المرور من مجموعة مميزة
الى أخرى:
6 ـ 1 ـ ٳماهة الألسان:
ـ ماهي العوامل التي يجب توفرها من أجل ضم الماء الى الألسان ؟
يمكن ضم
الماء الى الألسان، بوجود عامل محفز مثل حمض الفوسفورH3PO4، أو حمض الكبريت H2SO4
ـ ماذا ينتج عن تفاعل ضم الماء الى الألسان ؟
ينتج عن
تفاعل ضم الماء الى الألسان كحول. وفق المعادلة الكيميائية التالية:
CnH2n + H2O → CnH2n+1OH
ـ أعط مثال عن تفاعل ضم الماء الى الألسان ؟
C2H4 + H2O → C2H5OH
ويمكن كتابة المعادلة الكيميائية السابقة بالصيغة المفصلة كما يلي:

نعبر عن جزيء الماء بالصيغة شبه المفصلة التالية:H – OH
ـ أين يتم تثبيت OH، وكذلك H بالنسبة لذرتي الكربون المتصلتين بالرابطة الثنائية ؟
ٳن ضم مركب من الشكلH
– A ، لرابطة ثنائية في السان (CnH2n)، تؤدي بشكل تفضيلي الى تثبيت المجموعة A على ذرة
الكربون، التي تحتوي على أقل عدد من ذرات الهيدروجين، وتثبيت ذرة الهيدروجين، على ذرة
الكربون التي تحتوي العدد الأكبر، من ذرات الهيدروجين.
عند ٳماهةCH3 – CH = CH2 ينتج CH3 – CH2 – CH2OH بنسبة قليلة جدا، وينتج CH3 – CHOH – CH3 بنسبة كبيرة جدا.
6 ـ 2 ـ الأكسدة المقتصدة للكحول:
ـ ماذا ينتج عن الأكسدة المقتصدة لكل صنف من أصناف الكحولات ؟
ينتج عن الأكسدة
المقتصدة للكحول الأولي ألدهيد.
.webp)
وينتج عن الأكسدة المقتصدة للكحول الثانوي كيتون.
.webp)
أما الكحولات
الثالثية فهي لا تتأكسد بالأكسدة المقتصدة.
6 ـ 3 ـ نزع الماء من الكحول:
ـ ماهي الشروط الواجب توفرها من أجل نزع الماء من الكحول ؟
يمكن نزع الماء من داخل الجزيئات
الكحولية بتوفير طاقة كبيرة، وعند درجة حرارة من رتبة 450ºC ، وينتج عن
ذلك ألكن (السان).
عند نزع الماء من الايثانول. نتحصل على الاثلين وفق المعادلة الكيميائية
التالية:

كما يمكن نزع الماء بين الجزيئات
الكحولية بتوفير طاقة ضعيفة، وعند درجة حرارة من رتبة 250ºC، وينتج عن
ذلك (ٳيثر ـ أكسيد).
عند نزع الماء من جزيئتي ٳيثانول نتحصل على (ٳيثرأكسيد)، وهو ثنائي ٳيثيل ٳيثرأكسيد وفق المعادلة الكيميائية
التالية:

اقرأ حلول تمارين الكتاب المدرسي حول مدخل الى الكيمياء العضوية
.webp)




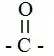
.webp)

تعليقات
إرسال تعليق