التحولات حمض-أساس: ثابت الحموضة والكواشف الملونة
التحولات حمض-أساس: ثابت الحموضة والكواشف الملونة
تعرف على أساسيات التحولات حمض-أساس، وكيفية فهم ثابت الحموضة (Ka) واستخدام الكواشف الملونة في الكيمياء. دليل شامل ومبسط يساعدك على تعزيز معرفتك بأساسيات الكيمياء بطريقة علمية ومنظمة.
ملاحظة: توجد وثيقة التلميذ بصيغة الـ PDF في نهاية المقال
6 ـ ثابت الحموضة Ka للثنائية (أساس/ حمض):
ليكن التفاعل التالي:
HA(aq) + H2O(l)= H3O+(aq) + A-(aq)
1 ـ عرف الـ Ka ثم أوجد عبارته ؟
الـ Ka هو ثابت الحموضة للثنائية (HA/A-)، ويساوي ثابت التوازن في حالة تفاعل حمض مع الماء، أو انحلاله فيه، ويعطى بالعبارة التالية:
2 ـ أوجد عبارة الـ pKa ؟
يعطى بالعبارة التالية: pKa = - logKa
3 ـ ما هو الهدف من حساب الـ Ka و الـ pKa ؟
الهدف من حساب الـ Ka و الـ pKa هو المقارنة بين قوق الاحماض فيما بينها، وقوة الأسس فيما بينها
ـ كلما كان
Ka أكبر كان pKa أصغر، فكان الحمض أقوى، والأساس أضعف.
ـ كلما كان Ka أصغر كان pKa أكبر، فكان الأساس أقوى، والحمض أضعف.
4 ـ أوجد العلاقة بين الـ pH و الـ pKa ؟
لدينا:
ومنه:
ومنه:
ومنه:
ومنه:
وباستخدام المصطلحات الشائعة ( و ) نكتب:
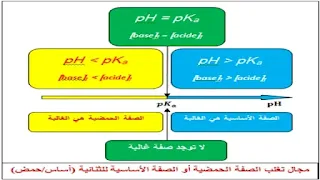
7 ـ مجال تغلب النوع الكيميائي:
من العلاقة:
نميز ثلاث حالات:
الحالة الأولى: إذا كان
- نجد:
- ومنه:
- وبالتالي:
- النتيجة: لا توجد صفة غالبة.
الحالة الثانية: إذا كان
- نجد:
- ومنه:
- وبالتالي:
- النتيجة: الصفة الأساسية هي الغالبة.
الحالة الثالثة: إذا كان
- نجد:
- ومنه:
- وبالتالي:
- النتيجة: الصفة الحمضية هي الغالبة.
8 ـ الكواشف الملونة:
ـ عرف الكاشف الملون ؟
نأخذ ثلاثة أنابيب اختبار، نضع في الأول كمية من الماء المقطر، وفي الثاني كمية من محلول حمض الايثانويك، وفي الثالث كمية من محلول الصود. نضيف قطرات من أزرق البروموثيمول إلى كل محلول.
نلاحظ أن محتوى الأنبوب رقم (1) يتلون باللون الخضر، ومحتوى الأنبوب رقم (2) يتلون باللون الأصفر، ومحتوى الأنبوب رقم (3) يتلون باللون الأزرق.
الكاشف الملون عبارة عن ثنائية )أساس/حمض( حيث الصفة الحمضية والصفة الأساسية ليس لهما نفس اللون، ونرمز للثنائية بالرمز: HIn/In-
يعطي أزرق البروموثيمول اللون الأخضر في الوسط المعتدل، واللون الأصفر في الوسط الحامضي، واللون الأزرق في الوسط القاعدي.
ـ بالاعتماد على نتائج النشاط (4)
1 ـ أوجد عبارة الـ Ki ، الـ pKi ؟
معادلة تفاعل الكاشف الملون مع الماء هي:
HIn(aq)+ H2O(l) → H3O+(aq) + In-(aq)
نرمز لثابت الحموضة للثنائية HIn/In- بالرمز Ki
حيث:
pKi = - logKi
2 ـ ما هو الهدف من حساب الـ Ki والـ pKi ؟
الهدف من حساب الـ Ki
والـpKi هو تحديد مجال التغير اللوني، وبالتالي قيمة الـ pH
3 ـ أوجد العلاقة بين الـ pH و الـ pKi ؟
العلاقة بين و
4 ـ كيف يمكن استنتاج مجال التغير اللوني للكاشف الملون ؟
لون المحلول يعتمد على النسبة:
وعليه فهو يتعلق بقيمة .
ـ إذا كان R > 10 فان الصفة In-
تشكل أغلبية ونجد:pH > pKi + 1
ـ إذا كان R < 1/10 فان الصفة HIn تشكل أغلبية ونجد:pH < pKi - 1
ـ من أجل المجال pKi– 1 < pH < pKi + 1، حيث [In-]f يقارب [HIn]f فان لون المحلول يكون مزيج من اللونين، لهذا يسمى هذا المجال )مجال التغير اللوني(
V ـ التحولات حمض ـ أساس:
المعايرة pH مترية:
تمهيد:
في إطار مراقبة جودة المنتوج، ومحاربة الغش نستعمل طريقة المعايرة، و للتعرف أكثر على هذه الطريقة نقترح في هذه التجربة معايرة محلول حمض الخل بمحلول الصود.
الوسائل والمحاليل المستعملة:
ـ محلول هيدروكسيد الصوديوم (Na+(aq)+ OH-(aq)) تركيزه المولي
Cb = 10-1 mol.L-1.
ـ قارورة زجاجية تحتوي على حمض الخل CH3COOH(aq) مجهول التركيز.
ـ محاليل معلومة الـ pH: pH1 = 4
، pH2 = 7 ، pH3 = 10
ـ عدة كواشف ملونة: الهليانتين، فينول فتالين، أزرق بروموثيمول.
ـ ماصة عيارية 1 mL. ـ حوجلة عيارية 100 mL. ـ مخلاط مغناطيسي. ـ سحاحة مدرجة. ـ بيشر سعته 100 mL.
ـ جهاز pH متر.
خطوات العمل:
1/ أذكر البروتوكول التجريبي لمعايرة محلول حمض الخل بمحلول الصود ؟
أ ـ نضبط جهاز الـ pH متر بواسطة محاليل معلومة الـ pH.
ب ـ نملأ السحاحة بمحلول ماءات الصوديوم ونضبطها عند التدريجة 0.
جـ ـ نضع في بيشر حجما
20 mL من حمض الخل [CH3COOH](aq).
د ـ نقطر تدريجيا محلول هيدروكسيد الصوديوم (Na+(aq)+ OH-(aq)) في البيشر ونسجل قيمة الـ pH بعد كل إضافة ثم ندون نتائج في الجدول.
2/ أكمل البيانات على الشكل ؟
إتمام البيانات:
جدول القياسات
18,5 | 18,0 | 15,0 | 12,0 | 8,0 | 6,0 | 4,0 | 2,0 | 0 |
Vb(mL) |
5,9 | 5,8 | 5,3 | 5,0 | 4,6 | 4,4 | 4,2 |
3,8 | 3,4 | PH |
| 23,0 | 22,0 | 21,5 | 21,0 | 20,5
| 20,0 | 19,5 | 19,0 | Vb(mL) |
| 11,2 | 11,0 | 10,9 |
10,7 | 10,4 | 8,6 | 6,4 | 6,1 | PH |
3/ أكتب معادلة التفاعل الحادث ؟
CH3COOH(aq) + HO-(aq)= CH3COO-(aq) + H2O(l)
4/ مثل البيان pH = f(Vb)؟
5/ أ ـ اشرح أجزاء هذا المنحنى مبينا في كل جزء المتفاعل المحد ؟
يتكون المنحنى من ثلاثة أجزاء:
الجزء الأول:
0 < Vb < 19,5 mL نلاحظ تغير بطيء في قيمة الـ pH مع زيادة معتبرة من المحلول الأساسي، ويبقى الوسط حامضي، ومنه المتفاعل المحد هو شوارد HO-
الجزء الثاني:
19,5 < Vb < 20,5 mL نلاحظ تغير مفاجئ في قيمة الـ pH مع زيادة قليلة جدا من المحلول الأساسي، ويتغير الوسط من حامضي الى أساسي، ومنه المتفاعل المحد يتغير من شوارد HO-
الى جزيئات CH3COOH
الجزء الثالث:
Vb > 20,5 mL نلاحظ تغير بطيء في قيمة الـ pH مع زيادة معتبرة من المحلول الأساسي، ويصبح الوسط أساسي تماما، و يصبح المتفاعل المحد هو جزيئات CH3COOH
ب ـ استنتج من ذلك تعريف نقطة التكافؤ ؟
نقطة التكافؤ هي النقطة التي:
ـ يحدث عندها تغير المتفاعل المحد.
ـ تكون عندها كمية مادة الحمض والاساس متساويتان أي n(HO-) = n(CH3COOH)
6/ حدد نقطة التكافؤ بيانيا موضحا الطريقة المتبعة، واستنتج طبيعة المحلول عندئذ ؟
أ ـ طريقة المماسين:
ـ نرسم مماسين متوازيين في نقطتي انعطاف بيان الدالة pH = f(Vb)
ـ نرسم مستقيما ثالثا يوازيهما، ويكون محور تناظر بالنسبة لهما.
ـ فتكون نقطة تقاطع المستقيم الثالث (المنصف) مع البيان هي نقطة التكافؤ E، بالإسقاط نجد احداثياتها:
VbE= 20 mL و pHE = 8,4
ب ـ طريقة الدائرتين:
جـ ـ طريقة المشتقة:
يمكن تحديد نقطة التكافؤ باستعمال طريقة المشتقة بتمثيل المنحنى dpH/dVb= g(Vb) اعتمادا على برنامج Excel وبتطبيق العلاقة:
نحصل على المنحنى التالي:
ثم نسقط القيمة القصوى على المنحنىpH = f(Vb) ونستنتج نقطة التكافؤ.
د ـ باستعمال الكواشف الملونة (المعايرة اللونية):
الكواشف الملونة عبارة عن محاليل حمضية، أو أساسية يتغير لونها من وسط الى اخر حسب مجال تغلب الصفة الحمضية HIn أو الصفة الأساسية In-
ـ المحلول الناتج عند التكافؤ يكون أساسيا.
7/ أ ـ أنشئ جدولا لتقدم التفاعل عند نقطة التكافؤ، و استنتج العلاقة بين Ca، Va، Cb، VbE؟
CH3COOH(aq) + HO-(aq) = CH3COO-(aq + H2O(l) | معادلة التفاعل | ||||
كميات المادة (mol) | التقدم x(mol) | حالة الجملة | |||
بوفرة | 0 | CbVb |
CaVa | 0 | الحالة الابتدائية |
بوفرة | x | CbVb – x = 0 | CaVa – x = 0 | x | الحالة الانتقالية |
بوفرة | xE | CbVbE – xE = 0 | CaVa – xE = 0 | xE | حالة التكافؤ |
العلاقة بين
Ca، Va، Cb، VbE:
عند التكافؤ:
ومنه:
وبالتالي:
ب ـ أحسب التركيز المولي لمحلول حمض الخل ؟
لدينا:
ومنه:
8/ تعرف نقطة نصف التكافؤ بالنقطة التي يكون عندها حجم المحلول الأساسي المسكوب هو Vb = VbE /2 ؟
ـ حدد على البيان قيمة الـ pH الموافقة ماذا تمثل ؟
من البيان pH = 4,8 وهي توافق قيمة الـ pKa للثنائية CH3COOH/CH3COO -
9/ أحسب ثابت التوازن K لهذا التحول الحادث. ماذا تستنتج ؟
لدينا:
بضرب البسط والمقام في :
ومنه:
ومنه:
وبالتعويض نجد:
وبما أن:
يمكن اعتبار تفاعل المعايرة الحادث تامًا.
10/ في غياب جهاز الـ pH متر، ما هو الكاشف الملون المناسب لهذه المعايرة من بين الكواشف التالية ؟
|
الكاشف |
الهليانتين |
أزرق البروموتيمول |
الفينول فتالين |
|||
|
نوع الوسط |
وسط حمضي |
وسط قاعدي |
وسط حمضي |
وسط قاعدي |
وسط حمضي |
وسط قاعدي |
|
لون الكاشف |
وردي |
أصفر |
أصفر |
أزرق |
شفاف |
بنفسجي |
|
مجال التغير اللون (تقريبا) |
3,1 – 4,4 |
6,0 – 7,6 |
8,2 – 10,0 |
|||
حسب الجدول الكاشف المناسب لهذه المعايرة هو الفينول فتالين لأن pHE لهذه المعايرة ينتمي الى مجال تغيره اللوني.
اقرأ الأحماض والأسس: تعريفها وتأثيرها على الماء
اقرأ تطور جملة كيميائية نحو حالة التوازن
وثيقة التلميذ بصيغة الـ PDF

.webp)
.webp)





تعليقات
إرسال تعليق